 前期及胎儿生长受限等发病机制中的作用已备受重视[6-7],而关于RSA绒毛组织中ET-l及其受体的表达情况尚无明确报道。本研究检测URSA绒毛组织中ET-1及受体mRNA及蛋白的表达,同时检测ET-1及受体对滋养细胞迁移能力的影响,探讨其与URSA的关系。
前期及胎儿生长受限等发病机制中的作用已备受重视[6-7],而关于RSA绒毛组织中ET-l及其受体的表达情况尚无明确报道。本研究检测URSA绒毛组织中ET-1及受体mRNA及蛋白的表达,同时检测ET-1及受体对滋养细胞迁移能力的影响,探讨其与URSA的关系。·基础研究·
【摘要】目的 通过检测内皮素-1(endothelin-1, ET-1)及受体(endothelin receptors, ETR)在不明原因复发性流产(unexplained recurrent spontaneous abortion, URSA)绒毛组织中的表达,探讨其与URSA的关系。方法 不明原因复发性流产患者30例(RSA组)及正常早孕人流妇女30例(正常组,即CTL组),采用实时荧光定量PCR(Real-Time PCR)及Western印迹法检测两组绒毛组织中ET-1、ETR-A、ETR-B mRNA及蛋白的表达。取体外培养的妊娠早期绒毛外滋养细胞Transwell迁移实验法检测ET-1、ETR-A阻断剂BQ-123及ETR-B阻断剂BQ-788受体对绒毛外滋养细胞迁移能力的影响。结果 RSA组较正常组绒毛组织中ETR-B mRNA及蛋白表达降低,差异有统计学意义(P<0.05),而ET-1、ETR-A mRNA及蛋白在二组绒毛组织中的表达差异无统计学意义(P>0.05)。ET-1促进HTR-8细胞迁移,ETR-B阻断剂阻断ET-1的促迁移作用。 结论 ET-1可能通过ETR-B受体促进妊娠早期绒毛外滋养细胞迁移,URSA患者较正常组绒毛中ETR-B mRNA及蛋白表达降低可能与URSA相关。
【关键词】不明原因复发性流产; 绒毛; 内皮素-1; 内皮素受体; 迁移
复发性流产(recurrent spontaneous abortion, RSA)是指连续发生2次或2次以上自然流产者。病因复杂,主要包括遗传因素、子宫解剖异常、感染因素、内分泌异常、血栓前状态、免疫紊乱等,除此之外,仍有50%病因不明,称为不明原因复发性流产(unexplained recurrent spontaneous abortion, URSA)[1]。正常人类胎盘形成依赖绒毛外滋养细胞(extravillous trophoblast, EVT)对子宫内膜间质及血管结构的浸润,完成子宫螺旋动脉的重铸,以建立母胎血液循环。已知在RSA中,绒毛浸润是严重缺失的,可导致滋养细胞过度凋亡和母体螺旋动脉不完全栓塞等诱发流产[2-3]。而滋养细胞迁移及浸润过程受母胎界面微环境中的多种因素调控。
内皮素-1(endothelin-1, ET-1)是迄今为止发现的最强的血管活性肽类物质,其不仅具有缩血管作用,作为激素调节肽和生长因子尚具有促进细胞增殖、迁移、浸润等作用[4]。内皮素受体(endothelin receptor, ETR)有ETR-A和ETR-B二种亚型,前者主要介导血管收缩和增殖,后者主要介导血管舒张及细胞迁移浸润。研究发现ET-1及其受体表达于人类胎盘滋养细胞[5],参与妊娠生理、病理机制调节。近年来ET-1及其受体在子 前期及胎儿生长受限等发病机制中的作用已备受重视[6-7],而关于RSA绒毛组织中ET-l及其受体的表达情况尚无明确报道。本研究检测URSA绒毛组织中ET-1及受体mRNA及蛋白的表达,同时检测ET-1及受体对滋养细胞迁移能力的影响,探讨其与URSA的关系。
前期及胎儿生长受限等发病机制中的作用已备受重视[6-7],而关于RSA绒毛组织中ET-l及其受体的表达情况尚无明确报道。本研究检测URSA绒毛组织中ET-1及受体mRNA及蛋白的表达,同时检测ET-1及受体对滋养细胞迁移能力的影响,探讨其与URSA的关系。
1.1 标本来源及采集
选择2014年1月至2014年6月在同济大学附属第一妇婴保健院接受治疗的30例URSA患者为RSA组。入组条件: (1) 二次自然流产史及以上;(2) 无生殖道畸形;(3) 无内分泌异常;(4) 无绒毛染色体异常;(5) 无 生殖道感染;(6) 无自身抗体阳性和自身免疫性疾病。同期就诊要求终止妊娠的30例正常早孕妇女为正常组,即CTL组。入组条件: (1) 停经后无不规则阴道出血;(2) 超声提示宫内妊娠,有心管搏动;(3) 既往无自然流产病史。RSA组年龄28~35岁,平均(31.23±2.29)岁;孕周7~12周,平均(9.24±1.12)周;正常组年龄 28~34岁,平均年龄(30.77±2.08)岁;孕周7~10周,平均(8.84±1.21)周,两组年龄及孕周比较差异无统计学意义(P>0.05)。在无菌操作下采集两组妇女离体绒毛,用PBS液清洗,放置-80℃液氮保存。
1.2 细胞株
HTR-8细胞株,购于中科院上海生命科学研究院细胞中心。
1.3 试剂
RNA提取试剂盒、实时定量PCR试剂盒购自美国TaKaRa公司,BCA-100蛋白质定量测定试剂盒购自上海碧云天生物技术有限公司,Anti-ET抗体、Anti-ETRA抗体、Anti-ETRB抗体购自美国Abcam公司。
1.4 方法
1.4.1 实时荧光聚合酶链反应(Real-Time PCR) 取液氮中保存的绒毛组织,研磨成粉末,按照总RNA提取试剂盒说明书提取总RNA,紫外分光光度计上测定RNA纯度及浓度。每份样品取1μl,按照反转录试剂盒说明书进行cDNA合成,引物由上海生工生物有限公司合成,引物序列见表1。按照SYBR Green荧光定量试剂盒进行PCR反应,反应条件: 预变性95℃ 30s,PCR反应(95℃ 5s, 60℃ 30s)40个循环。以GAPDH为内参,2-ΔΔCt法进行基因相对表达分析。
表1 ET-1 、ETR-A、ETR-B mRNA 基因引物序列
Tab.1 Tthe primer sequences of ET-1, ETR-A and ETR-B mRNA
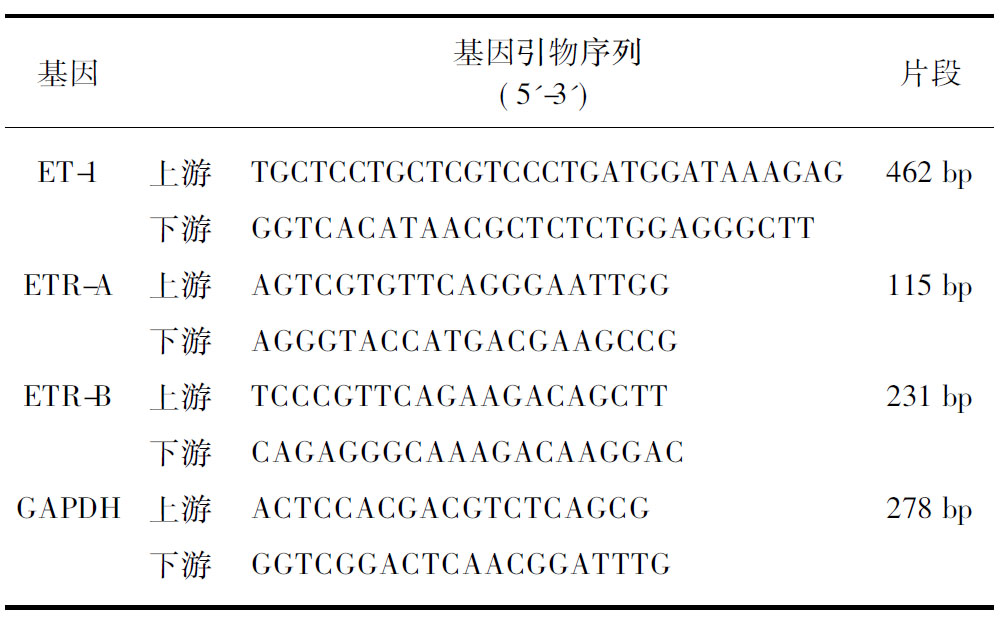
基因基因引物序列(5'-3')片段ET-1上游TGCTCCTGCTCGTCCCTGATGGATA-AAGAG462bp下游GGTCACATAACGCTCTCTG-GAGGGCTTETR-A上游AGTCGTGTTCAGGGAATTGG115bp下游AGGGTACCATGACGAAGCCGETR-B上游TCCCGTTCAGAAGACAGCTT231bp下游CAGAGGGCAAAGACAAGGACGAPDH上游ACTCCACGACGTCTCAGCG278bp下游GGTCGGACTCAACGGATTTG
1.4.2 Western印迹法检测 取液氮中保存绒毛组织,研磨后加入组织裂解液,匀浆液离心后取上清,采用BCA法进行蛋白含量测定。取20μl蛋白质经10%SDS-PAGE垂直凝胶电泳,后电转移至PVDF膜上,加适量5%脱脂奶粉室温封闭1h,加入一抗(鼠抗人ET-1单克隆抗体、兔抗人ETRA、ETRB多克隆抗体,1∶1000 封闭液稀释),室温孵育2h。用TBST漂洗3次,每次5min。加入二抗(羊抗兔或鼠的HRP-IgG,1∶2000稀释),室温振荡孵育1h。TBST洗膜,滴加ECL发光试剂,显影、摄片。以GAPDH为内参,采用凝胶图像分析系统进行蛋白相对表达分析。
1.4.3 细胞迁移试验 HTR-8细胞置于含1%青链霉素、10%胎牛血清的DMEM-F12完全培养液中,于37℃、5%CO2细胞培养箱中培养,待细胞生长至对数期,用0.25%胰蛋白酶消化收集细胞。将Transwell小室插入24孔细胞培养板,分别在上室铺设9种不同处理因素的细胞悬液。对照组: 1%FBS培养基;ET-1刺激组: 1%FBS培养基,0.01、0.1、1、10nmol/L四组浓度ET-1;ET-1受体阻断剂组: 1%FBS 培养基,0.1nmol/L ET-1,1、10μmol/L浓度ETR-A阻断剂BQ-123或ETR-B阻断剂BQ-788。将HTR-8细胞按照5×103/孔的密度接种于9组不同培养基中;下室分别给予10%FBS培养基800μl。置37℃、5%CO2培养箱培养24h。培养结束后,下室加入1μl荧光染色剂染色,继续置37℃、5%CO2培养箱培养0.5h。荧光显微镜下拍照(×100,4个 固定视野拍照),计数迁移至下层的细胞数。
1.5 统计学处理
采用SPSS 16.0统计软件,计数资料用![]() ±s表示,t检验相关分析,P<0.05为差异有统计学意义。
±s表示,t检验相关分析,P<0.05为差异有统计学意义。
2.1 RSA组与正常组绒毛中ET-1、ETR-A、ETR-B mRNA 的表达
RSA组及正常组绒毛组织中均表达ET-1、ETR-A、ETR-B mRNA, RSA组绒毛中ETR-B mRNA表达较正常组显著下降,差异有统计学意义(P<0.05),而ET-1、ETR-A mRNA在两组绒毛中表达差异无统计学意义(P>0.05),见图1。
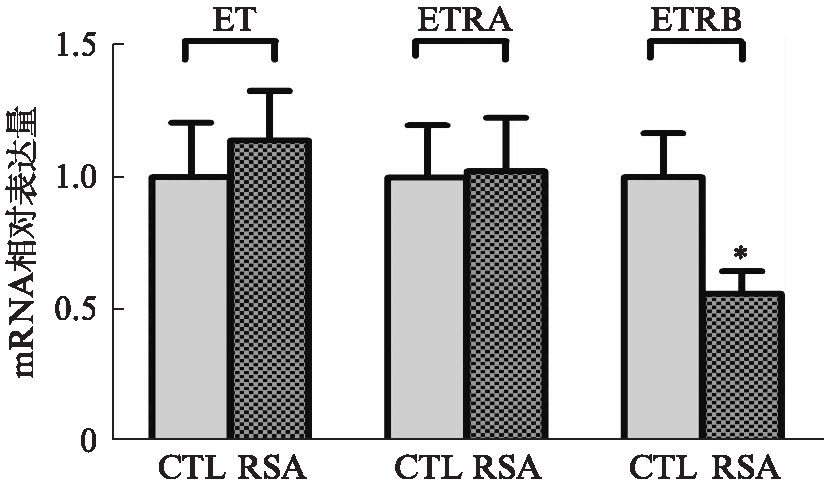
图1 RSA组及正常组绒毛中ET-1、ETR-A、 ETR-B mRNA表达情况
Fig.1 mRNA expression of ET-1, ETR-A and ETR-B in villi of women with URSA and normal pregnancy 与CTL组相比,*P<0.05
2.2 RSA组及正常组绒毛中ET-1、ETR-A、ETR-B蛋白的表达
在蛋白水平上RSA组及正常组绒毛组织中均表达ET-1、ETR-A、ETR-B,RSA组绒毛中ETR-B蛋白表达低于正常组,差异有统计学意义(P<0.05),而ET-1、ETR-A蛋白在两组绒毛中表达差异无统计学意义(P>0.05),见图2。
2.3 ET-1及受体对HTR-8细胞迁移能力的影响
运用Transwell迁移实验检测ET-1及受体对HTR-8细胞迁移能力的影响,在0.01nmol/L ET-1组,HTR-8迁移细胞数较对照组增加25%,差异有统计学意义 (P<0.05),在 0.01~10nmol/L不同浓度ET-1组中, HTR-8迁移细胞数随ET-1浓度增加而增加,呈剂量依赖。在两组ETR-A阻断剂组中, HTR-8迁移细胞数较相同浓度 ET-1组差异无统计学意义 (P>0.05)。在两组 ETR-B阻断剂组中, 1μmol/L BQ-788组HTR-8迁移细胞数较相同浓度ET-1组减少42.32%,10μmol/L BQ-788组HTR-8迁移细胞数较相同浓度ET-1组减少79.44%,差异均有统计学意义(P<0.05),见图3、4。
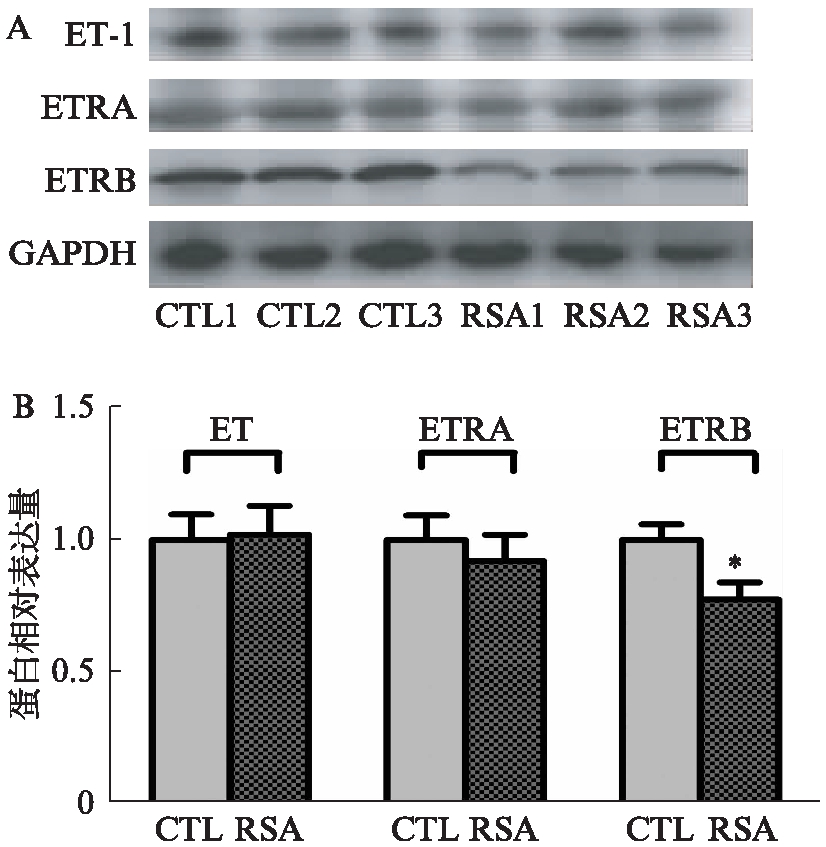
图2 RSA组及正常组绒毛中ET-1、ETR-A、 ETR-B蛋白表达情况
Fig.2 Protein expression of ET-1, ETR-A and ETR-B in villi of women with URSA and normal pregnancy 与CTL组相比,*P<0.05
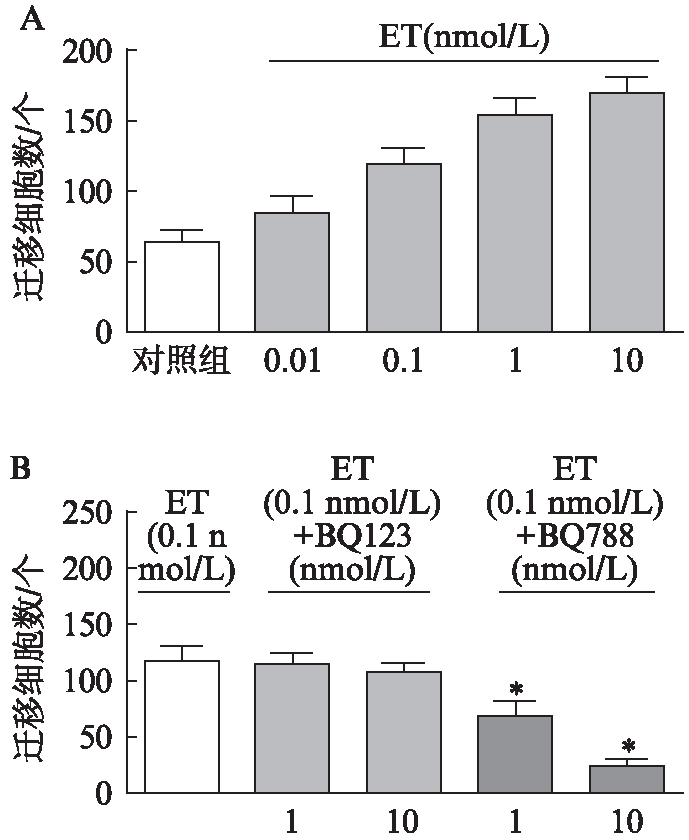
图3 ET-1和ETR阻断剂对HTR8细胞迁移的影响
Fig.3 The role of ET-1 and ETR antagonist in the regulation of HTR-8 cell migration
A: 对照组及不同浓度ET-1(0.01、0.1、1、10nmol/L)对HTR-8细胞迁移的影响;B: ET-1(0.1nmol/L)及不同浓度ETR阻断剂BQ123、BQ788对HTR8细胞迁移的影响;与ET组相比,*P<0.05

图4 ET-1及ETR阻断剂对HTR8细胞迁移的影响
Fig.4 The role of ET-1 and ETR antagonist in the regulation of HTR-8 cell migration
A: 对照组;B: 0.01nmol/L ET-1组;C: 0.1nmol/L ET-1组;D: 0.1nmol/L ET-1+10μmol/L BQ-788组
人类妊娠滋养层细胞来源于胚胎的胚外层,包括细胞滋养细胞、合体滋养细胞、绒毛外滋养细胞三个亚群。在胚胎植入过程中,滋养层细胞具有类似肿瘤细胞侵袭和转移的特性,通过绒毛外滋养细胞对母体蜕膜的侵袭及螺旋动脉的重塑过程,促进胎盘形成[8]。适当的滋养细胞侵入深度对胎盘的成功植入至关重要,滋养细胞侵袭不足可能造成自然流产、子 前期及胎儿生长受限等疾病的发生[9]。这一侵蚀过程,受多种旁分泌及自分泌因子的严格调控,包括多种细胞因子、生长因子、生长因子结合蛋白、蛋白多糖和细胞外基质蛋白及激素等[10]。
前期及胎儿生长受限等疾病的发生[9]。这一侵蚀过程,受多种旁分泌及自分泌因子的严格调控,包括多种细胞因子、生长因子、生长因子结合蛋白、蛋白多糖和细胞外基质蛋白及激素等[10]。
ET-1是一类血管活性肽类物质及生长因子,具有调节血管紧张度、促进细胞增殖、浸润、迁移等作用,ETR-A和ETR-B对增殖均起作用,而浸润仅通过ETR-B起作用。Cervar等[4]研究表明,在妊娠早期,滋养细胞主要表达ETR-B受体,支持ETR-B受体促进滋养细胞迁移、侵袭,在晚期胎盘中,ETR下降,ETR-A主要分布在绒毛膜板及绒毛干等近端绒毛的血管组织中,而ETRB主要分布在中间绒毛及末端绒毛中,ET受体在妊娠早期和妊娠晚期胎盘的定位与表达水平不同,提示ETR在胎盘发育中起着不断变化的作用[5]。本研究结果显示: RSA组绒毛中ETR-B mRNA及蛋白表达低于正常组,而ET-1、ETR-A mRNA及蛋白表达差异无统计学意义,由此猜测,URSA绒毛组织中ETR-B mRNA及蛋白表达降低,滋养细胞迁移、侵袭能力下降,可能影响子宫血管重铸,导致胎盘“浅着床”,可能与流产有关。
绒毛外滋养细胞具有高度迁移、侵袭功能,HTR-8细胞是体外扩增的绒毛外滋养细胞体系,其具有原位绒毛外滋养细胞表型及功能特性。本研究HTR-8细胞迁移结果显示,ET-1促进HTR-8细胞迁移,并呈剂量依赖,ETR-B阻断剂BQ-788阻断ET-1促进迁移的作用。由此推测ET-1可能通过ETR-B受体促进妊娠早期绒毛外滋养细胞迁移,在局部环境中适当浓度的ET-1及受体可能对胚泡正常发育、着床起重要作用。
综上所述,妊娠早期ET-1可能通过ETR-B受体促进绒毛外滋养细胞迁移,URSA绒毛组织中ETR-B mRNA及蛋白表达水平明显降低,有助于进一步探讨ET-1与URSA发病的关系。
【参考文献】
[1] 张建平,林其德,李大金,等.复发性流产的诊断与治疗[J].现代妇产科进展,2006,15(7): 481-492.
[2] Jauniaux E, Hempstock J, Greenwold N, et al. Trophoblastic Oxidative stress in relation to temporal and regional differences in maternal placental blood flow in normal and abnormal early pregnancies[J]. AM J Pathol, 2003,162(1): 115-125.
[3] Cervar M, Puerstner P, Kainer F, et al. Endothelin-1 stimulates the proliferation and invasion of first trimester trophoblastic cellsinvitro-a possible role in the etiology of pre-eclampsia[J]. J Investig Med, 1996,44(8): 447-453.
[4] Cervar M,Dieber M, Barth S, et al. Endothelin-1 stimulates proliferation of first- trimester trophoblasts via the A- and B-type receptor and invasion via the B-type receptor[J]. J Clin Endocrinol METR-Ab, 2011,96(11): 3408-3415.
[5] Struck J, Morgenthaler NG, Bergmann A. Proteolytic processing pattern of the endothelin-1 precursorinvivo[J]. Peptides, 2005,26(12): 2482-2486.
[6] George E, Palei AC, Granger JP. Endothelin as a final pathway in the pathophysiolopy of preeclampsi
A: therapeutic implications[J]. Curr Opin Nephrol Hypertens, 2012,21(2): 157- 162.
[7] George E, Grange JP. Endothelin: key mediator of hypertension in preeclampsia[J]. Am J Hypertension, 2011,24(9): 964-969.
[8] Burton GJ, Jauniaux E. Placental oxidative stress, From miscarriage to preeclampsia[J]. J Soc Gynecol Investig, 2004,11(6): 342-352.
[9] Anin SA, Vince G, Quenby S. Trophoblast invasion[J]. Hum Fertil(Camb), 2004,7(3): 169-174.
[10] Chakraborty C, Gleeson LM, McKinnon T, et al. Regulation of human trophoblast migration and invasiveness[J]. Can J Physiol Pharmacol, 2002,80(2): 116-124.
Expression of endothelin-1 and endothelin receptors in villi and its relation to unexplained recurrent spontaneous abortion
【Abstract】Objective To investigate the expression of endothelin-1(ET-1) and endothelin receptors(ETRs)in villi and its relation to unexplained recurrent spontaneous abortion(URSA). Methods The expressions of ET-1, ETR-A, ETR-B mRNA and protein were determined with Real-Time PCR and Western blotting in villi tissue of 60 early pregnancy women(30 URSA and 30 normal pregnancy), respectively. Extravillous trophoblast(EVT) HTR-8 cells were treated with ET-1, ETR-A antagonist BQ-123 and ETR-B antagonist BQ-788, respectively. The migration function of HTR cells was assessed by Transwell assay. Results Compared to normal controls the levels of ETR-B mRNA and protein in villi tissue of URSA women were decreased(P<0.05),while there was no significant difference in ET-1 and ETR-A mRNA and protein levels between two groups(P>0.05).The migration of HTR-8 cells was stimulated by ET-1 and the migration-promoting was blocked in the presence of the ETR-B antagonist. Conclusion The results indicate that ET-1 promotes EVT migration through ETR-B in the first trimester of gestation, and the downregulated expression of ETR-B might be involved in the etiology of URSA.
【Key words】unexplained recurrent spontaneous abortion; villi; endothelin-1; endothelin receptor; migration
doi:10.16118/j.1008-0392.2015.02.002
收稿日期:2015-01-18
【中图分类号】R 711
【文献标志码】A
【文章编号】1008-0392(2015)02-0006-05